Бутан, получение, свойства, химические реакции
Содержание:
- Что такое бутан?
- Зачем смешивают пропан и бутан в автономной системе газоснабжения
- Последствия и проблемы со здоровьем
- Реакции
- Основные физико-химические свойства компонентов СУГ и продуктов их сгорания
- Пропорции газов
- Бутан (вещество)
- История
- Физико-химические свойства
- Чистый н-бутан
- Эффекты и проблемы со здоровьем [ править ]
- Физические свойства бутана:
- Ссылки [ править ]
- Реакции [ править ]
- Дегидрирование бутана
- Что такое бутан?
- Сфера применения газа
- Химические свойства бутана:
- Структурная изомерия
- Ссылки [ править ]
- Бутан молярная масса
- Сфера применения газа
Что такое бутан?
Бутан – это так называемый сжиженный природный (нефтяной) газ, который получается при перегонке нефти.
Как и пропан, бутан по своей природе является газом, но это относится не ко всем горючим газам. Бутан становится жидким при -0,5 градусах Цельсия или ниже, в то время как пропан становится жидким только при -40 градусах Цельсия. Другим большим отличием между бутаном и пропаном является давление: при температуре 20 градусов Цельсия бутан имеет давление около 1,2 бар, тогда как пропан не менее 7,0 бар.
Оба изомера бутана являются газами при комнатной температуре, потому что (n-) бутан имеет температуру плавления -138 C и температуру кипения -0,5 C, а метилпропан (изобутан) имеет температуру плавления -160 C и температуру кипения −12 °С. Бутан практически не растворим в воде (90 мг / л). Оба изомера ведут себя схожим образом: они легко воспламеняются, не обесцвечивают бромную воду и раствор перманганата калия, подвергаются воздействию только галогенов хлора и брома под воздействием света.
Зачем смешивают пропан и бутан в автономной системе газоснабжения
Учитывая физико-химические характеристики насыщенных углеводородов, их применение во многом зависит от климатических условий. Сжиженный бутан в чистом виде не будет работать при отрицательных температурах. Тогда как применение чистого пропана противопоказано в условиях жаркого климата, поскольку высокая температура вызывает чрезмерное повышение давления в газовом резервуаре.
Так как для каждого региона нецелесообразно производить отдельную марку газа, с целью унификации ГОСТом предусмотрена смесь с определенным содержанием двух компонентов в рамках установленных норм. Согласно ГОСТ 20448-90 максимальное содержание бутана в данной смеси не должно превышать 60%, при этом для северных регионов и в зимнее время года доля пропана должно быть не меньше 75%.

Процентное соотношение газов в разное время года
Кстати, больше статей нашего блога о газификации — в этом разделе.
Последствия и проблемы со здоровьем
Вдыхание бутана может вызвать эйфорию , сонливость , потерю сознания , асфиксию , сердечную аритмию , колебания артериального давления и временную потерю памяти при злоупотреблении непосредственно из контейнера под высоким давлением и может привести к смерти от удушья и фибрилляции желудочков . Он попадает в кровоток и в считанные секунды вызывает интоксикацию. Бутан является наиболее распространенным летучим веществом в Великобритании и был причиной 52% смертей, связанных с растворителями, в 2000 году. Распыляя бутан прямо в горло, струя жидкости может быстро охладиться до -20 ° C (-4 ° C). F) путем расширения, вызывая длительный ларингоспазм . Синдром « », впервые описанный Бассом в 1970 году, является наиболее частой причиной смерти, связанной с растворителями, приводя к 55% известных смертельных случаев.
Реакции
Промышленное использование иллюстрирует тенденцию бутадиена к полимеризации. Его восприимчивость к реакциям 1,4-присоединения иллюстрируется его гидроцианированием. Как и многие диены, он претерпевает катализируемые палладием реакции, протекающие через аллильные комплексы. Он является партнером в реакциях Дильса-Альдера , например, с малеиновым ангидридом с образованием тетрагидрофталевого ангидрида .
Как и другие диены, бутадиен является лигандом для комплексов низковалентных металлов, например производных Fe (бутадиен) (CO) 3 и Mo (бутадиен) 3 .
Строение (бутадиен) трикарбонила железа .
Основные физико-химические свойства компонентов СУГ и продуктов их сгорания
К основным характеристикам СУГ относят:
- температуру испарения/конденсации;
- температуру воспламенения;
- теплоту сгорания;
- плотность;
- объемное расширение.
Важными характеристиками являются пределы взрываемости при смешении с воздухом, быстрота распространения огня при горении, условия для полного сгорания.
Температура испарения/конденсации
При нормальном давлении составляет:
- для пропана – минус 42 °C;
- для бутана – минус 0,5 °C.
Если температура газов поднимается выше этих значений, они начинают испаряться, при опускании ниже – конденсироваться. Как правило, сжиженный газ поставляется в форме смеси (бутан+пропан). Поэтому фактическая температура испарения/конденсации зависит от их соотношения.
Обычно газ, поставляемый зимой, сохраняет испаряемость до минус 20 °C. Но иногда производитель поставляет смесь с повышенным количеством бутана. Это приводит к тому, что даже при небольшом понижении температуры ниже нуля газ перестает испаряться.
Температура воспламенения
Она равна:
- для пропана – от 504 до 588 °C;
- для бутана – от 430 до 569 °C.
При этих значениях температуры газ может воспламениться даже при отсутствии открытого огня – если имеются предметы, которые нагреты до высокой температуры, но еще не светятся.
Теплота сгорания
Этот параметр характеризует количество тепла, выделяемое при сгорании 1 м3 газа. Он равен:
- для пропана – 22…24 тыс. ккал. (91…99 МДж/ м3);
- для бутана – 28…31 тыс. ккал. (118…128 МДж/ м3).
Пределы взрываемости
Это очень важная с точки зрения безопасности характеристика. При определенном соотношении смесь газов с воздухом или кислородом может взрываться. Вероятность взрыва зависит от скорости распространения огня. Чем она выше, тем опаснее ситуация. В свою очередь скорость распространения огня зависит от пропорции газов. Нужно иметь в виду, что при увеличении температуры границы взрываемости расширяются.
При смешении газа с воздухом он становится взрывоопасным при следующих соотношениях:
- пропан – 2,1%…9,5%;
- бутан – 1,5%…8,5%;
- смесь – 1,5%…9,5%.
Плотность
Плотность газообразной фазы в норме составляет:
- пропана – 2,019 кг/ м3;
- бутана – 2,703 кг/ м3.
Плотность жидкой фазы – 0,5…0,6 кг/л.
Как видим, пары СУГ весят больше воздуха, плотность которого равна 1,29 кг/м3. Это приводит к тому, что при утечках газ собирается внизу помещения, где в относительно малом количестве может образовать с воздухом взрывоопасную смесь. Визуально это может быть похоже на дымку или стелющийся туман. При утечках из подземных коммуникаций и емкостей СУГ заполняют непроветриваемые углубления, подвалы, канализационные колодцы и остаются там довольно долго. Визуально обнаружить утечки трудно. Не выходя на поверхность, они растекаются под землей на довольно большие расстояния.
Объемное расширение
Объемное расширение жидкой фазы в 16 раз выше, нежели у воды. Это создает опасность разрыва баллона при увеличении температуры.
Степень сгораемости
Чтобы газ сгорал полностью, на 1 м3 его паров должно приходиться:
- для пропана – 24 м3 воздуха или 5,0 м3 О2;
- для бутана – 31 м3 воздуха или 6,5 м3 О2.
При испарении 1 кг жидкого газа образуется:
- пропана – 0,51 м3 паров;
- бутана – 0,386 м3 паров.
При испарении 1 л газа образуется:
- пропана – 0,269 м3 паров;
- бутана – 0,235 паров м3.
Скорость распространения огня
Пламя горящего бутана распространяется с максимальной скоростью 0,826 м/сек, пропана – 0,821 м/сек.
Цвет и запах
Чистые СУГ бесцветны и лишены запаха. Это создает опасность неконтролируемых утечек с последующим образованием взрывоопасных смесей. Чтобы облегчить своевременное обнаружение утечек, СУГ подвергают одоризации (приданию запаха) техническим этилмеркаптаном.
Пропорции газов
Для топливной смеси бутан является более калорийным топливом, а пропан выступает в качестве сжиженного газа, который испаряется при низких температурах. Поэтому соотношение пропана и бутана в смеси зависит от климатических условий региона, в которых пропан-бутан используется, а также времени года.
Чем ниже температура, тем больше пропана должно быть в смеси (не менее 70—80%), тогда пропан обеспечит наилучшее испарение газа и, следовательно, топливо будет стабильно и надежно подаваться к потребителю.
А вот летом можно использовать смесь с содержанием пропана, не превышающим 40%
Если вы набираете топливо летом, а использовать его планируете зимой, то обратите свое внимание на газ с 60-70-процентным содержанием пропана
Бутан (вещество)
Бутан имеет два изомера:
Физические свойства
Бутан — бесцветный горючий газ, со специфическим запахом, при нормальном давлении легко сжижаем от −0,5 °C, замерзает при −138 °C; при повышенном давлении и обычной температуре — легколетучая жидкость. Критическая температура +152 °C, критическое давление 3,797 МПа.
- Растворимость в воде — 6,1 мг в 100 мл (для н-бутана, при 20 °C), значительно лучше растворяется в органических растворителях). Может образовывать азеотропную смесь с водой при температуре около 100 °C и давлении 10 атм.
- Плотность жидкой фазы — 580 кг/м³
- Плотность газовой фазы при нормальных условиях — 2,703 кг/м³, при 15 °C — 2,550 кг/м³
- Теплота сгорания 45,8 МДж/кг (2657 МДж/моль (см.).
Нахождение и получение
Содержится в газовом конденсате и нефтяном газе (до 12 %). Является продуктом каталитического и гидрокаталитического крекинга нефтяных фракций. В лаборатории может быть получен по реакции Вюрца:
Сероочистка (демеркаптанизация) бутановой фракции
Прямогонную бутановую фракцию необходимо очищать от сернистых соединений, которые в основном представлены метил- и этил- меркаптанами. Метод очистки бутановой фракции от меркаптанов заключается в щелочной экстракции меркаптанов из углеводородной фракции и последующей регенерации щелочи в присутствии гомогенных или гетерогенных катализаторов кислородом воздуха с выделением дисульфидного масла.
Применение и реакции
При свободнорадикальном хлорировании образует смесь 1-хлор- и 2-хлорбутана. Их соотношение хорошо объясняется разницей в прочности связей С—Н в позиции 1 и 2 (425 и 411 кДж/моль).
При полном сгорании на воздухе образует углекислый газ и воду. Бутан применяется в смеси с пропаном в зажигалках, в газовых баллонах в сжиженном состоянии, где он имеет запах, так как содержит специально добавленные одоранты. При этом используются «зимние» и «летние» смеси с различным составом. Теплота сгорания 1 кг — 45,7 МДж (12,72 кВт·ч).
При недостатке кислорода образуется сажа, угарный газ или их смесь:
Фирмой DuPont разработан метод получения малеинового ангидрида из н-бутана при каталитическом окислении:
н-Бутан — сырьё для получения бутилена, 1,3-бутадиена, компонент бензинов с высоким октановым числом. Бутан высокой чистоты и особенно изобутан может быть использован в качестве хладагента в холодильных установках. Производительность таких систем немного ниже, чем фреоновых, но бутан безопасен для окружающей среды, в отличие от фреоновых хладагентов.
В пищевой промышленности бутан зарегистрирован в качестве пищевой добавки E943a, а изобутан — E943b, как пропеллент.
Биологические эффекты
Вдыхание бутана вызывает удушье и сердечную аритмию. При попадании на тело сжиженного газа или струи его испарений вызывает охлаждение до −20 °C, что крайне опасно при ингаляциях.
История
В 1863 году, французский химик Е. Caventou изолированного бутадиен от пиролиза из амилового спирта . Этот углеводород был идентифицирован как бутадиен в 1886 году после того, как Генри Эдвард Армстронг выделил его среди продуктов пиролиза нефти. В 1910 году русский химик Сергей Лебедев полимеризовал бутадиен и получил материал с каучукообразными свойствами. Однако этот полимер оказался слишком мягким, чтобы заменить натуральный каучук во многих областях применения, особенно в автомобильных шинах.
Бутадиеновая промышленность возникла в годы, предшествовавшие Второй мировой войне. Многие из воюющих стран понимали, что в случае войны они могут быть отрезаны от каучуковых плантаций, контролируемых Британской империей , и стремились уменьшить свою зависимость от натурального каучука. В 1929 году Эдуард Чункер и Вальтер Бок , работая в IG Farben в Германии, создали сополимер стирола и бутадиена, который можно было использовать в автомобильных шинах. Вскоре последовало мировое производство: бутадиен производился из зернового спирта в Советском Союзе и Соединенных Штатах и из угольного ацетилена в Германии.
Физико-химические свойства
По своей структуре и характеристикам пищевой антифламинг Е-943a Бутан можно причислять к группе органических соединений, которые относятся к классу алканов. В свою очередь алканы представляют собой ациклические углеводы. Свое оригинальное название пищевой антифламинг Е-943a Бутан получил благодаря английскому названию масляной кислоты или butanic acid. Стоит отметить, что пищевой антифламинг Е-943a Бутан находится в газообразном агрегатном состоянии. Кроме того газ Бутан считается в больших концентрациях токсичным соединением, которое может привести к летальному исходу.
При воздействии большой концентрации пищевого антифламинга Е-943a Бутан на человека, смерть может наступить в результате дисфункции дыхательного аппарата. Как правило, газообразное соединение бутан образуется при обработке нефти и нефтепродуктов, а также природного газа. В свою очередь природный газ представляет собой смесь различных газообразных веществ, которые скапливаются в недрах Земли в результате анаэробного разложения различных органических веществ. Стоит особенно подчеркнуть, что пищевой антифламинг Е-943a Бутан как представитель углеводородных соединений считается опасным взрывчатым веществом.
Кроме того пищевой антифламинг Е-943a Бутан способен самовоспламенятся, причем в процессе горения соединений источает специфический характерный запах. Бутан хотя и относят к веществам 4-го класса опасности для человеческого организма, это соединение может оказывать наркотическое воздействие, а в больших количествах приводить к токсическому отравлению и смерти. В результате исследований медики пришли к выводу о том, что Е-943a способен оказывать тяжелое и стойкое вредное воздействие на нервную систему.
Чистый н-бутан
Чистый н-бутан при 100 С в присутствии А1С1з не подвергается изомеризации. Но достаточно ввести в смесь 2 43 % бутиленов, как начнется изомеризация бутана с образованием в равновесной смеси до 45 % изобутана.
Чистый н-бутан при 100 С в присутствии А1С1з не подвергается изомеризации. Но достаточно ввести в смесь 2 43 % бутиленов, как начинается изомеризация бутана с образованием в равновесной смеси до 45 % изобутана.
Химически чистый н-бутан содержал менее 0 2 / 0 изобутана и менее 0 01 % олефинов. В дальнейшем он очищался от олефина пропусканием над гранулированным хлористым алюминием при комнатной температуре, под атмосферным давлением с объемной скоростью, равной единице.
|
Схема лабораторной хроматографической установки для выделения бутенов. |
Для выделения чистого н-бутана, изобутена, транс-бу-тена — 2, гыс-бутена-2 и бутадиена лучшим оказался носитель ИНЗ-600 фракции 0 5 — 1 мм, обработанный 30 % эфира ТЭГНМ.
Пайнз и Уокер показали, что изомеризация чистого н-бутана в присутствии А1С13 НС1 не происходит без прибавления олефинов ( или другого источника карбониевых ионов), если только при самой изомеризации не образуются олефины или подобные им вещества.
Пайнс и Уоккер , Облад и Горин показали, что очень чистый н-бутан при полном отсутствии олефина или кислорода не изомеризуется каталитической системой хлористый алюминий — хлористый водород, по-видимому, потому, что ион карбония в отсутствие олефина не образуется. Но изомеризации не происходит, если те же самые парафины контактируют с более устойчивыми кислыми материалами, например глиноземом, которые являются намного более слабыми кислотами. Однако, если на глинозем нанести небольшое количество платины, катализатор становится очень активным и действует селективно в отношении изомеризации парафина.
Первой стадией процесса является выделение и очистка бу-тиленов, а также получение практически чистого н-бутана, возвращаемого на дегидрирование. Катализат дегидрирования н-бутана компримируется и из него удаляются водород и низкокипящие примеси.
Первой стадией процесса является выделение и очистка бу-тиленов, а также получение практически чистого н-бутана, возвращаемого на дегидрирование.
Помимо введения алкенов и алкилгалогенидов в реакционную смесь имеются и другие способы промотировать изомеризацию чистого н-бутана. Эти методы, по-видимому, основаны на непрямом введении алкенов или алкилгалогенидов в реакционную смесь. Сопровождающий изомеризацию крекинг, вероятно, ведет к образованию алкенов или карбоний-ионов. Кислород расходуется в этом процессе. Это может быть объяснено двояко: а) по одному из возможных механизмов кислород окисляет бутан в бутильный карбоний-ион; б) кислород взаимодействует с галогенидом алюминия, в результате чего образуется некоторая форма оксигалогенида и галоид, который реагирует с н-бутаном и дает бутилгалогенид.
|
Схема установки для очистки — бутана. |
Дьюара со смесью сухого льда с ацетоном ( температура около-35 С); 6 — предохранительная склянка; 8, 14 — банк с ледяной водой; IS — пустая склянка; IS-змеевиковый конденсатор; 17-сосуд Дьюара; / — приемник чистого н-бутана; I-V1 — краны.
Мабери и Худсон были, пожалуй, первыми исследователями, занявшимися изучением хлорирования я-бутана. Они хлорировали почти чистый н-бутан и получили, по их сообщению, только монохлорид, кипящий при температуре 68 — 69 С.
Роберте и Хамилл облучали смеси w — бутана и циклогексана. Выходы метана, измеренные для чистого н-бутана и смесей, содержащих 10 и 20 об. % цикло — СеН, составили 0 20; 0 09 и 0 03 соответственно.
Подготавливают прибор к работе, нагревают печь хроматермографа № 5 до температуры в максимуме 100 С и устанавливают ее в исходном верхнем положении. Устанавливают определенную скорость потока газа-носителя и наносят порцию чистого н-бутана или его смеси с воздухом. Устанавливают заданную скорость движения печи и включают механизм, опускающий ее вниз. Следят за температурой и выходом н-бутана. В момент достижения максимума пика н-бутана измеряют температуру, при которой происходит его десорбция, и полученное значение записывают.
Эффекты и проблемы со здоровьем [ править ]
Вдыхание бутана может вызвать эйфорию , сонливость , потерю сознания , асфиксию , сердечную аритмию , колебания артериального давления и временную потерю памяти при злоупотреблении непосредственно из контейнера под высоким давлением и может привести к смерти от удушья и фибрилляции желудочков . Он попадает в кровоток и в течение нескольких секунд вызывает интоксикацию. Бутан является наиболее распространенным летучим веществом в Великобритании и был причиной 52% смертей, связанных с растворителями, в 2000 году. Распыляя бутан прямо в горло, струя жидкости может быстро охладиться до -20 ° C (-4 ° F) за счет расширения, вызывая длительный ларингоспазм . Синдром », впервые описанный Бассом в 1970 году, является наиболее частой причиной смерти, связанной с растворителями, приводя к 55% известных смертельных случаев.
Физические свойства бутана:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | специфический характерный запах |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (состояние вещества – жидкость, при 0 °C), кг/м3 | 601,2 |
| Плотность (состояние вещества – газ, при 0 °C), кг/м3 | 2,672 |
| Температура плавления н-бутана, °C | -138,4 |
| Температура плавления изобутана, °C | -159,6 |
| Температура кипения н-бутана, °C | -0,5 |
| Температура кипения изобутана, °C | -11,7 |
| Температура самовоспламенения, °C | 372 |
| Критическая температура*, °C | 152,01 |
| Критическое давление, МПа | 3,797 |
| Критический удельный объём, м3/кг | 228 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 1,4 до 9,3 |
| Удельная теплота сгорания, МДж/кг | 45,8 |
| Молярная масса, г/моль | 58,12 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Ссылки [ править ]
- ^
- Хофманн, Август Вильгельм Фон (1 января 1867 г.). «I. О действии трихлорида фосфора на соли ароматических монаминов». Труды Лондонского королевского общества . 15 : 54–62. DOI . S2CID .
- ^ «Передний вопрос». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 4. DOI . ISBN
- WB Kay (1940). «Соотношение давление-объем-температура для н-бутана». Промышленная и инженерная химия . 32 (3): 358–360. DOI .
- . США: Matheson Tri-Gas Incorporated. 5 февраля 2011 года Архивировано из на 1 октября 2011 года . Проверено 11 декабря 2011 года .
- . www.chem.qmul.ac.uk .
- Уоттс, Х. (1868). Словарь по химии . 4 . п. 385.
- Maybery, CF (1896). «О составе серных нефтей Огайо и Канады». Труды Американской академии искусств и наук . 31 : 1–66. DOI . JSTOR .
- (2009). «Разница энтальпии между конформациями нормальных алканов: исследование спектроскопии комбинационного рассеяния н- пентана и н- бутана». J. Phys. Chem. . 113 (6): 1012–9. DOI . PMID .
- . houstonchronicle.com . 21 июня 2016 . Проверено 20 сентября 2018 года .
- . Сканк Фарм Исследования . 2013-08-26 . Проверено 5 декабря 2019 .
- . thcfarmer.com. 19 Декабрь 2009 . Дата обращения 3 октября 2016 .
- Филд-Смит М., Бланд Дж. М., Тейлор Дж. С. и др. . Департамент общественного здравоохранения. Лондон: Медицинская школа Святого Георгия. Архивировано из 27 марта 2007 года.
- ^ Рэмси Дж., Андерсон Х.Р., Блур К. и др. (1989). «Введение в практику, распространенность и химическую токсикологию злоупотребления летучими веществами». Hum Toxicol . 8 (4): 261–269. DOI . PMID . S2CID .
- Басс М. (1970). «Внезапная нюхательная смерть». JAMA . 212 (12): 2075–2079. DOI . PMID .
Реакции [ править ]
Спектр синего пламени горелки с бутаном, показывающий излучение полосы молекулярных радикалов CH и полосы C 2 Swan
Когда кислорода много, бутан горит с образованием двуокиси углерода и водяного пара; когда кислород ограничен, также может образоваться углерод ( сажа ) или оксид углерода . Бутан плотнее воздуха.
Когда кислорода достаточно:
- 2 C 4 H 10 + 13 O 2 → 8 CO 2 + 10 H 2 O
Когда кислород ограничен:
- 2 C 4 H 10 + 9 O 2 → 8 CO + 10 H 2 O
По весу бутан содержит около 49,5 МДжкг (13,8 кВтч / кг; 22,5 МДж / фунт ) или по объему жидкости 29,7 мегаджоулей на литр (8,3 кВтч / л; 112 МДж / галлон США; 107000 БТЕ / галлон США).
Максимальная адиабатическая температура пламени бутана с воздухом составляет 2243 К (1970 ° C; 3578 ° F).
н- Бутан является сырьем для каталитического процесса DuPont получения малеинового ангидрида
- 2 СН 3 СН 2 СН 2 СН 3 + 7 О 2 → 2 С 2 Н 2 (СО) 2 О + 8 Н 2 О
н- Бутан, как и все углеводороды, подвергается свободнорадикальному хлорированию, давая как 1-хлор-, так и 2-хлорбутаны, а также более сильно хлорированные производные. Относительные скорости хлорирования частично объясняются разной энергией диссоциации связи , 425 и 411 кДж / моль для двух типов связей CH.
Дегидрирование бутана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
| Например, при дегидрировании бутана преимущественно образуются бутен-2 (бутилен) или бутин-2. |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
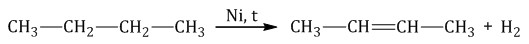
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

Что такое бутан?
Бутан – это так называемый сжиженный природный (нефтяной) газ, который получается при перегонке нефти.
Как и пропан, бутан по своей природе является газом, но это относится не ко всем горючим газам. Бутан становится жидким при -0,5 градусах Цельсия или ниже, в то время как пропан становится жидким только при -40 градусах Цельсия. Другим большим отличием между бутаном и пропаном является давление: при температуре 20 градусов Цельсия бутан имеет давление около 1,2 бар, тогда как пропан не менее 7,0 бар.
Оба изомера бутана являются газами при комнатной температуре, потому что (n-) бутан имеет температуру плавления -138 C и температуру кипения -0,5 C, а метилпропан (изобутан) имеет температуру плавления -160 C и температуру кипения −12 °С. Бутан практически не растворим в воде (90 мг / л). Оба изомера ведут себя схожим образом: они легко воспламеняются, не обесцвечивают бромную воду и раствор перманганата калия, подвергаются воздействию только галогенов хлора и брома под воздействием света.
Сфера применения газа
Пропан-бутан представляет собой уникальное вещество на газовой основе, которое имеет в своем составе одноименные молекулы.
Общепризнанная химическая формула пропана состоит из молекул и атомов двух основных составляющих – пропана (С3Н8) и бутана (С4Н10).
Широко используемый в бытовых целях, этот газ применяется практически везде – начиная с приготовления еды на сковороде, и заканчивая резкой толстого слоя металла, активным использованием его на различных производствах вообще.
Также им все чаще заправляют свои автомобили люди, отказавшиеся от топлива на бензиновой основе.

Химические свойства бутана:
Бутан трудно вступает в химические реакции. В обычных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства бутана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое дегидрирование бутана:
CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2 (kat = Pt, Ni, Al2O3, Cr2O3, повышенная to).
- 2. галогенирование бутана:
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CH2-CH2-CH3 + I2 → CH3-CHI-CH2-CH3 + HI (hv или повышенная to).
Реакция носит цепной характер. Молекула брома или йода под действием света распадается на радикалы, затем они атакуют молекулы бутана, отрывая у них атом водорода, в результате этого образуется свободный бутил CH3-CH·-CH3, который сталкиваются с молекулами брома (йода), разрушая их и образуя новые радикалы йода или брома:
Br2 → Br·+ Br· (hv); – инициирование реакции галогенирования;
CH3-CH2-CH2-CH3 + Br· → CH3-CH·-CH2-CH3 + HBr; – рост цепи реакции галогенирования;
CH3-CH·-CH2-CH3 + Br → CH3-CHBr-CH2-CH3 + Br·;
CH3-CH·-CH2-CH3 + Br· → CH3-CHBr-CH2-CH3; – обрыв цепи реакции галогенирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование бутана проходит поэтапно – за один этап замещается не более одного атома водорода.
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CHBr-CH2-CH3 + Br2 → CH3-CBr2-CH2-CH3 + HBr (hv или повышенная to);
и т.д.
Галогенирование будет происходить и далее, пока не будут замещены все атомы водорода.
- 3. нитрование бутана:
См. нитрование этана.
- 4. окисление (горение) бутана:
При избытке кислорода:
2C4H10 + 13O2 → 8CO2 + 10H2O.
При нехватке кислорода вместо углекислого газа (СО2) получается оксид углерода (СО), при еще меньшем количестве кислорода выделяется мелкодисперсный углерод сажа (в различном виде, в т.ч. в виде графена, фуллерена и пр.) либо их смесь.
- 5. сульфохлорирование бутана:
C4H10 + SO2 + Cl2 → C4H9-SO2Cl + … (hv).
- 6. сульфоокисление бутана:
2C4H10 + 2SO2 + О2 → 2C4H9-SO2ОН (повышенная to).
Структурная изомерия
Для бутана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
|
Например.
Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан |
Для бутана не характерна пространственная изомерия.
Бутан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для бутана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для бутана характерны радикальные реакции.
Бутан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Ссылки [ править ]
- ^
- Хофманн, Август Вильгельм Фон (1 января 1867 г.). «I. О действии трихлорида фосфора на соли ароматических монаминов». Труды Лондонского королевского общества . 15 : 54–62. DOI . S2CID .
- ^ «Передний вопрос». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 4. DOI . ISBN
- WB Kay (1940). «Соотношение давление-объем-температура для н-бутана». Промышленная и инженерная химия . 32 (3): 358–360. DOI .
- . США: Matheson Tri-Gas Incorporated. 5 февраля 2011 года Архивировано из на 1 октября 2011 года . Проверено 11 декабря 2011 года .
- . www.chem.qmul.ac.uk .
- Уоттс, Х. (1868). Словарь по химии . 4 . п. 385.
- Maybery, CF (1896). «О составе серных нефтей Огайо и Канады». Труды Американской академии искусств и наук . 31 : 1–66. DOI . JSTOR .
- Роман М. Балабин (2009). «Разница энтальпии между конформациями нормальных алканов: исследование спектроскопии комбинационного рассеяния н- пентана и н- бутана». J. Phys. Chem. . 113 (6): 1012–9. DOI . PMID .
- . houstonchronicle.com . 21 июня 2016 . Проверено 20 сентября 2018 года .
- . Сканк Фарм Исследования . 2013-08-26 . Проверено 5 декабря 2019 .
- . thcfarmer.com. 19 Декабрь 2009 . Дата обращения 3 октября 2016 .
- Филд-Смит М., Бланд Дж. М., Тейлор Дж. С. и др. . Департамент общественного здравоохранения. Лондон: Медицинская школа Святого Георгия. Архивировано из 27 марта 2007 года.
- ^ Рэмси Дж., Андерсон Х.Р., Блур К. и др. (1989). «Введение в практику, распространенность и химическую токсикологию злоупотребления летучими веществами». Hum Toxicol . 8 (4): 261–269. DOI . PMID . S2CID .
- Басс М. (1970). «Внезапная нюхательная смерть». JAMA . 212 (12): 2075–2079. DOI . PMID .
Бутан молярная масса
Истинная, эмпирическая, или брутто-формула: C4H10
Химический состав Бутана
Молекулярная масса: 58,124
Бута́н (C4H10) — органическое соединение, углеводород класса алканов. В химии название используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана CH(CH3)3. Название происходит от корня «бут-» (французское название масляной кислоты — acide butyrique, от др.-греч. βούτῡρον, масло) и суффикса «-ан» (принадлежность к алканам). Вдыхание бутана вызывает дисфункцию лёгочно-дыхательного аппарата. Содержится в природном газе, образуется при крекинге нефтепродуктов, при разделении попутного нефтяного газа, «жирного» природного газа. Как представитель углеводородных газов пожаро- и взрывоопасен, малотоксичен, имеет специфический характерный запах, обладает наркотическими свойствами. По степени воздействия на организм газ относится к веществам 4-го класса опасности (малоопасные) по ГОСТ 12.1.007-76. Вредно воздействует на нервную систему.
Бутан — бесцветный горючий газ, со специфическим запахом, при нормальном давлении легко сжижаем от −0,5 °C, замерзает при −138 °C; при повышенном давлении и обычной температуре — легколетучая жидкость. Критическая температура +152 °C, критическое давление 3,797 МПа.
- Растворимость в воде — 6,1 мг в 100 мл (для н-бутана, при 20 °C), значительно лучше растворяется в органических растворителях). Может образовывать азеотропную смесь с водой при температуре около 100 °C и давлении 10 атм.
- Плотность жидкой фазы — 580 кг/м³
- Плотность газовой фазы при нормальных условиях — 2,703 кг/м³, при 15 °C — 2,550 кг/м³
- Теплота сгорания 45,8 МДж/кг (2657 МДж/моль).
Содержится в газовом конденсате и нефтяном газе (до 12 %). Является продуктом каталитического и гидрокаталитического крекинга нефтяных фракций. В лаборатории может быть получен по реакции Вюрца.
Сфера применения газа
Пропан-бутан представляет собой уникальное вещество на газовой основе, которое имеет в своем составе одноименные молекулы.
Общепризнанная химическая формула пропана состоит из молекул и атомов двух основных составляющих – пропана (С3Н8) и бутана (С4Н10).
Широко используемый в бытовых целях, этот газ применяется практически везде – начиная с приготовления еды на сковороде, и заканчивая резкой толстого слоя металла, активным использованием его на различных производствах вообще.
Также им все чаще заправляют свои автомобили люди, отказавшиеся от топлива на бензиновой основе.